乳腺癌细胞通常被大量的脂肪细胞包围,为癌前病变细胞提供一个独特的微环境。脂肪细胞对乳腺癌脂质代谢有重塑作用,游离脂肪酸(FFA)和脂滴可使乳腺癌细胞更具侵袭性。铁死亡是一种非细胞凋亡、细胞坏死、细胞自噬的新型的细胞程序性死亡方式,参与了包括三阴性乳腺癌(TNBC)在内的多种癌症的发生、发展和治疗靶点。有研究发现,多不饱和脂肪酸(PUFAs)可诱导脂质双分子层过氧化,外源性单不饱和脂肪酸(MUFAs)可抑制铁死亡。然而,目前乳腺脂肪细胞对TNBC铁死亡的影响尚不清楚。
2022年6月,复旦大学附属肿瘤医院胡夕春教授、王碧芸教授、陈光亮教授团队在Journal of Hematology & Oncology(IF=23.168)期刊在线发表题为“Mammary adipocytes protect triple‑negative breast cancer cells from ferroptosis”的文章。本研究通过体内外实验发现了脂肪细胞可以分泌特定的脂肪酸诱导乳腺癌细胞产生铁死亡抵抗,且该过程依赖于脂肪酸合成酶ACSL3,证实了与肿瘤周围脂肪细胞共培养的乳腺癌细胞显示出对铁死亡的抵抗。此外,研究团队还通过动物模型验证了脂肪细胞对三阴性乳腺癌的铁死亡保护。(麦特绘谱为本研究提供脂质组学检测分析)

研究人员首先建立乳腺脂肪细胞-乳腺癌细胞共培养体系,72h后发现共培养组的脂滴明显多于常规培养组。研究人员选择磺胺吡啶(SAS)作为铁死亡诱导剂,通过BODIPY™581/591C11染色检测脂质过氧化水平发现,TNBC细胞系BT-549和MDA-MB-231中,SAS诱导铁死亡发生均会导致细胞内脂质-ROS升高。
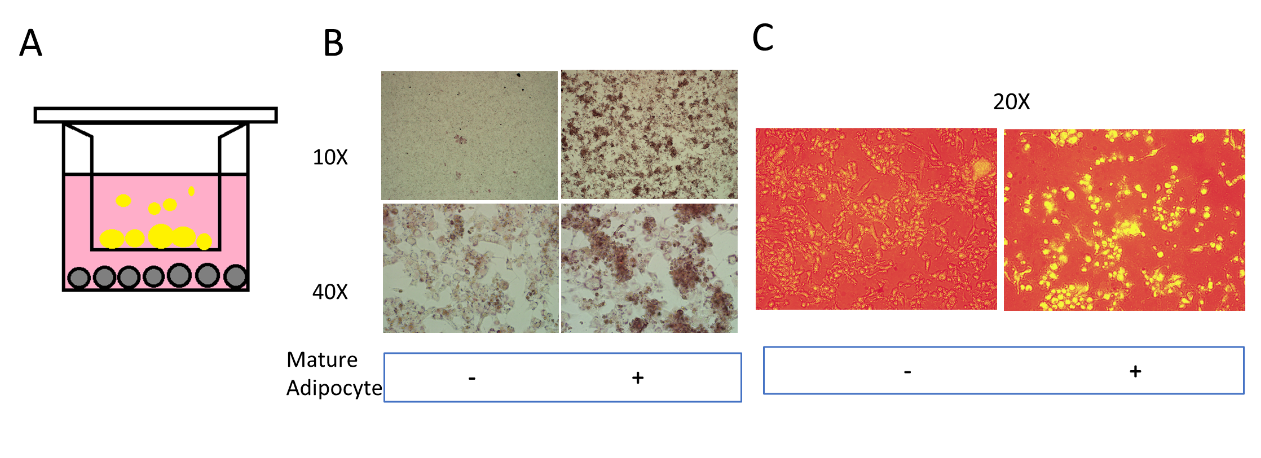
图1. 脂肪细胞-乳腺癌细胞共培养体系
通过流式细胞术检测发现,与正常培养的细胞相比,共培养的细胞显著抑制脂质过氧化,并在使用铁死亡抑制剂ferrostatin-1的同时得到一定程度的逆转。透射电子显微镜(TEM)也发现,与共培养细胞相比,SAS处理后的正常培养细胞线粒体过氧化现象明显增加,此外,SAS处理后共培养细胞的抑制率显著降低,克隆数显著增加,ferrostatin-1也能部分恢复生长抑制。研究人员还引入了凋亡抑制剂Z-VAD-FMK和自噬抑制剂3-MA,发现与ferrostatin-1相比,它们不能恢复SAS处理的细胞活力。这些结果提示脂肪细胞对乳腺癌细胞铁死亡有抑制作用。
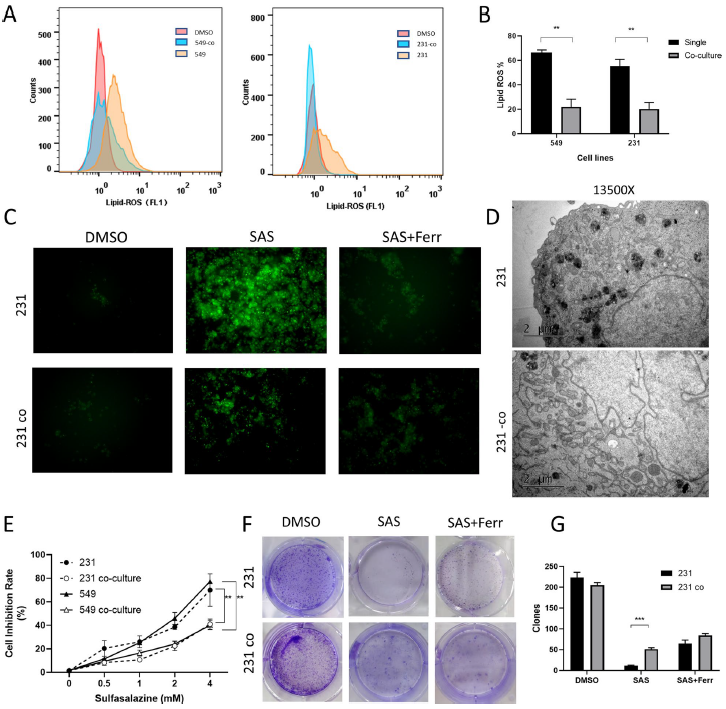
图2. 乳腺脂肪细胞保护乳腺癌细胞免于铁死亡
随后,研究人员对共培养和正常培养的MDA-MB-231细胞系进行脂质组学分析,结果显示共培养细胞中88种代谢物上调,12种代谢物下调。与正常培养的细胞相比,共培养细胞的磷脂生物合成途径有很大的提高。这些发现进一步说明,脂肪细胞通过磷脂生物合成相关代谢物抑制铁死亡,而含酸磷脂在铁死亡中起着至关重要的作用。此外,共培养的细胞系中非酯化脂肪酸(NEFA)水平显著高于正常培养的细胞系。

图3. 脂质组学分析
引入外源性甘油、油酸(MUFA)和硬脂酸(PUFA)后,与对照组相比,外源性油酸组显著抑制了脂质-ROS水平。细胞活力测试和克隆形成也显示了类似的结果。既往研究表明,外源性MUFA可以通过纤维肉瘤细胞和黑色素瘤细胞酰基辅酶A合成酶长链家族成员3 (ACSL3)依赖的方式降低质膜脂对致命氧化的敏感性。因此,研究人员使用shRNA对ACSL3敲低的细胞系进行研究,发现sh-ACSL3的脂质-ROS水平在脂肪细胞共培养组和外源性MUFA组中对BT-549和MDA-MB-231细胞系铁死亡的保护作用相反。
最后,在体内研究中,研究人员将MDA-MB-231细胞接种于裸鼠左腹股沟脂肪垫(FP)和右背部皮下(SC)。然后,小鼠接受SAS治疗。结果显示,整个给药期间,处理组和对照组小鼠体重无显著差异,耐受良好。与体外实验结果一致,铁死亡诱导剂SAS在SC组而非FP组中显著降低了肿瘤生长,表明脂肪细胞对铁死亡具有保护作用。

图4. 脂肪细胞在ACSL3存在的情况下,通过油酸保护乳腺癌细胞免于铁死亡
此外,研究人员通过油红色染色发现FP肿瘤中脂质增加,通过TEM发现SC肿瘤中线粒体损伤增加,SC肿瘤中谷胱甘肽过氧化物酶4 (GPX4)和可溶性载体家族7成员11 (SLC7A11)水平降低,这进一步证明了上述发现。有趣的是,此前的研究发现,淋巴结可以通过产生MUFA来保护黑色素瘤细胞免于铁死亡,从而增加肿瘤转移,在一定程度上与本研究结果相一致。
综上,本研究通过脂质组学、脂肪细胞-癌细胞共培养体系和体内细胞接种实验,发现脂肪细胞在ACSL3存在的情况下,通过脂代谢物MUFA保护乳腺癌细胞免于铁死亡。相信随着未来越来越多的临床试验在癌症患者中开展,这些发现或可为肿瘤治疗提供新思路。
原文文献
Mammary adipocytes protect triple-negative breast cancer cells from ferroptosis. Journal of Hematology & Oncology. 2022.
请扫码二维码阅读原文

上述研究由麦特绘谱提供脂质组学检测分析,近年来部分脂质组学客户案例如下:
①
●香港大学:SCD1/FADS2 fatty acid desaturases equipoise lipid metabolic activity and redox-driven ferroptosis in ascites-derived ovarian cancer cells
● Theranostics 2022 IF=11.6
● 研究内容:SCD1/FADS2脂肪酸去饱和酶控制卵巢癌细胞腹膜转移机制
②
●云南大学:mmBCFA C17iso ensures endoplasmic reticulum integrity for lipid droplet growth
● Journal of Cell Biology 2021 IF=10.539
● 研究内容:支链脂肪酸维护内质网稳态调控脂滴增长
③
● 云南大学:S100A11 Promotes Liver Steatosis via FOXO1-Mediated Autophagy and Lipogenesis
● Cellular and Molecular Gastroenterology and Hepatology 2020 IF=7.076
● 研究内容:S100A11通过FOXO1介导的自噬和脂肪生成促进肝脏脂肪变性
绘谱帮你测
麦特绘谱拥有成熟的代谢组学靶向和非靶向检测平台,包括全球独有技术Q600、Q300、Q200和各类小分子代谢物独立检测方法,菌群16S测序和宏基因组、转录组学及多组学联合分析等全套解决方案。独家的检测技术、全面的数据报告以及专业的售后探讨,助力您的科研探索之路不断创新和突破。欢迎联系获取详细资料!
往期推荐
1. 客户案例 | Microbiome:运动改善心功能不全,肠道菌群发挥重要作用
2. 客户案例 | NC:西湖大学团队发现饮茶或可降低慢性失眠带来的心血管代谢病风险
3. 客户案例 | Theranostics:香港大学研究团队揭示SCD1/FADS2脂肪酸去饱和酶控制腹膜转移新机制
4. 客户案例 | PNAS:厦门大学林树海团队发现调控新冠肺炎抗体水平的血浆代谢物

